
核膜“蜘蛛网”介导DNA修复:卡里姆·梅克海尔博士(Dr. Karim Mekhail)和其团队的突破性研究以及对癌症治疗的影响
多伦多大学的研究人员在卡里姆·梅克海尔博士(Dr. Karim Mekhail)的领导下,在理解DNA修复机制方面取得了重大进展,有望彻底改变癌症和早衰的治疗方法。他们的研究发表在《自然结构与分子生物学》杂志上,探讨了核膜在DNA修复中的作用,挑战了以往关于哺乳动物细胞中DNA移动性的假设。
传统上,DNA修复过程主要集中在细胞核内。然而,梅克海尔博士的团队发现,当DNA受损时,来自细胞质的微管丝会对核膜施加压力,形成管状结构或内陷。这些结构形成了网状结构,与细胞核内的受损DNA位点相互作用,显著提高了修复效率。这一过程类似于孩子们用手指推气球,产生凹痕但不破裂。研究结果揭示了核膜作为DNA修复的动态介质的角色,将其从一个被动的边界转变为维持遗传稳定性的积极参与者。
这一发现为核结构对DNA损伤的动态反应提供了新的见解,并开辟了潜在的治疗干预途径。在像早衰症(progeria)这样加速衰老的罕见遗传疾病中,过多的这些核管可能会损害DNA修复。研究表明,与早衰症相关的突变层粘连蛋白A(lamin A)会诱导这些管状结构,可能影响细胞修复DNA的能力。这项研究强调了跨学科合作的重要性,梅克海尔博士将这些进展归功于其团队的多样化专业知识。
研究进一步探讨了基因敲减以确定哪些基因在DNA修复期间对形成和拆解这些临时核膜结构是必需的。通过针对并消除这些称为dsbNETs的核膜管状结构,团队显著减少了携带BRCA1突变的小鼠三阴性乳腺癌细胞的肿瘤形成能力。尽管这些结果令人鼓舞,但需要进一步研究以将这些发现转化为临床应用。
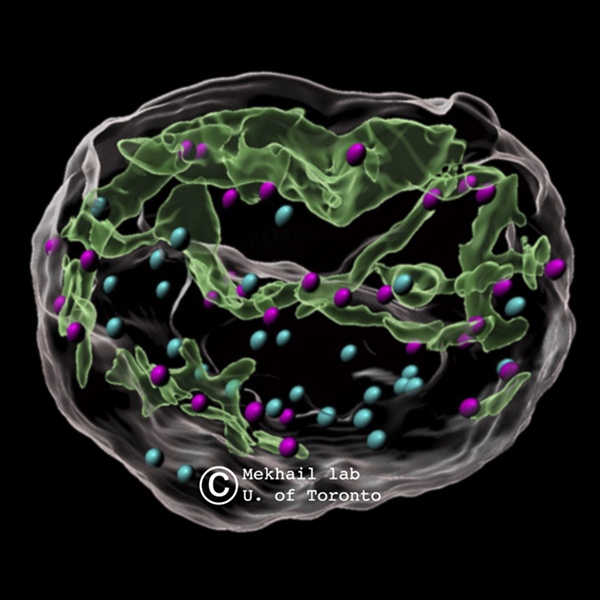
运动蛋白和微管丝在这一DNA修复过程中举足轻重。运动蛋白产生必要的运动来操纵细胞内的微管丝,类似于孩子的手指推气球。这种力量在核膜中创造了内陷,对DNA修复至关重要。研究集中在推动核膜形成dsbNETs的动力蛋白KIF5B和KIF13B上。另一种动力蛋白KIFC3则向相反方向移动,逆转在DNA修复期间形成的结构,确保细胞结构恢复到正常状态。
这些发现对癌症治疗具有重大意义。通过操纵dsbNET结构——无论是增强还是抑制它们——研究人员可以制定策略,有选择性地针对和控制癌细胞的生长。这种方法还可能有利于与早衰相关的疾病,其中涉及类似的DNA损伤和修复机制。最终目标是精准医疗,根据每个患者的具体特征定制治疗。尽管详细的定制化目前可能还无法完全实现,但将这些策略适应于不同类型的癌症应是可行,并且可能会产生显著的影响。
梅克海尔博士研究中最令人兴奋和最基本的方面之一是核在DNA修复期间的可逆变形概念。运动蛋白和微管丝驱动这一过程,重塑核膜以促进DNA修复,并在修复完成后将其恢复到原始状态。这种动态能力在有效管理DNA修复的同时保持了细胞的完整性。
此外,研究还揭示了PARP抑制剂在癌症治疗中的作用。通常,携带BRCA1和BRCA2突变的癌症严重依赖PARP进行DNA修复。PARP抑制剂阻止这些癌细胞修复DNA损伤,导致细胞死亡。dsbNETs的形成通过促进错误的修复和染色体融合,增加了PARP抑制剂的有效性,对癌细胞有害。操纵这些结构可以显著影响癌细胞对PARP抑制剂的反应,提供潜在的策略以增强治疗效果。
研究还表明,微管活动的增加和独特的核结构可以作为某些癌症的生物标志物。通过理解和识别这些核结构,病理学家和肿瘤学家可以更有效地诊断和定制治疗。这种方法可能会增强个性化医学,使对特定治疗反应的预测更准确,从而改善治疗结果。
梅克海尔博士的团队正在进一步解析控制dsbNETs形成和逆转的分子机制,同时探索基于调节这些结构的治疗途径。凭借团队的多样化专业知识,梅克海尔博士旨在将这些分子见解转化为实际疗法。
他们的研究主要集中在乳腺癌和卵巢癌上,因为这些癌症的普遍性和对癌症生物学的关键见解。此外,他们还在研究与早衰相关的疾病,如哈钦森-吉尔福德早衰综合症(HGPS)。这种疾病显著加速了儿童的衰老过程,梅克海尔博士的持续研究旨在改善受影响者的结果,同时增强我们对自然衰老过程的理解。
将这些发现转化为临床应用是一个漫长而复杂的过程,涉及严格的测试、监管审查和必要的批准。梅克海尔博士的研究有助于更广泛地理解癌症和衰老的分子层面,为可能彻底改变我们治疗这些疾病的创新治疗策略铺平了道路。最终目标是将分子见解转化为切实的治疗方法,改善患者的治疗结果,特别是面对难治性癌症和其他严重疾病的患者。这项工作强调了跨学科合作的重要性,以及全球科学界对推进生物医学科学和改善人类健康的奉献精神。
研究文章链接:
Shokrollahi, M., Stanic, M., Hundal, A. et al. DNA double-strand break–capturing nuclear envelope tubules drive DNA repair. Nat Struct Mol Biol (17 April 2024). https://doi.org/10.1038/s41594-024-01286-7
